Chemische binding en het principe van zijn vorming
Chemische binding is een vrij complex concept,die lang is gevormd op basis van de leringen en ideeën over de structuur van het atoom. Dus in de XVI-XVII eeuw. waren de eerste pogingen om de chemische overeenkomst te verklaren op basis van de corpusculaire theorie. R. Boyle, dacht dat de drijvende kracht achter chemische reacties het samenvallen van deeltjes is zoals het sleutelslot, dat wil zeggen, de atomen "verzameld" en "gedemonteerd", waardoor nieuwe substanties worden gevormd. Later in de XVIII eeuw. over de vervanging van de mechanische theorie komt de dynamiek, de aanhanger daarvan was I. Newton. Hij geloofde dat de oorzaak van chemische gelijkenis de aantrekkingskrachten van verschillende intensiteit zijn.

De elektronische aard van de verbinding wordt verklaard door een atoomwaterstof. Het is bekend dat het één ongepaard elektron bevat, dat zich op het eerste energieniveau bevindt. Wanneer twee waterstofatomen convergeren, begint de kern van een van hen de elektronen van de ander aan te trekken, en omgekeerd. Interactie tussen atomen vindt plaats tussen atomen, de afstand daartussen neemt af, wederzijdse aantrekking wordt gecompenseerd door afstoting van kernen. In het molecuul dat zojuist gevormd is, is de elektronendichtheid verhoogd.
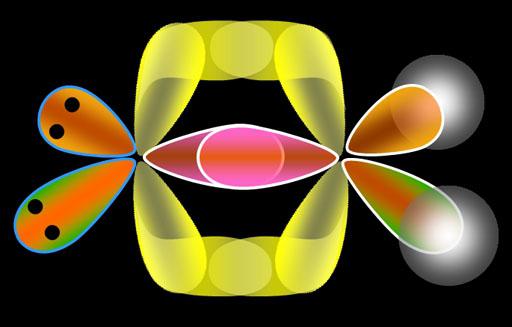
Niet alle atomen reageren echter op elkaar. Elektronische schalen van inerte gassen overlappen elkaar dus niet, d.w.z. ze blijven stabiel. Op basis hiervan wordt de Lewis-octetregel geformuleerd, die stelt dat de atomen van alle elementen bij de vorming van een chemische binding de neiging hebben om de elektronenschil te veranderen in de configuratie van het dichtstbijzijnde inerte gas, waardoor elektronen worden gevormd of bevestigd.
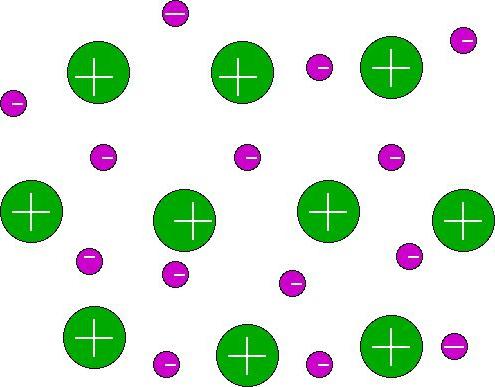
Op basis van al het bovenstaande, kunt u doende conclusie dat de chemische binding een interactie van atomen is, die optreedt als gevolg van de uitwisseling van elektronen of hun overgang van het ene elementaire deeltje van de materie naar de andere.
</ p>
