Laten we het hebben over het bepalen van het type hybridisatie
Laten we het hebben over het bepalen van het type hybridisatie en ook de geometrische structuur van het molecuul.
Geschiedenis van het uiterlijk
In het begin van de twintigste eeuw, L. Pauling stelde een theorie voor van de geometrie van moleculen met een covalente binding. Als basis voor de vorming van communicatie werd de overlapping van elektronenwolken genomen. De methode werd valentie-obligaties genoemd. Hoe het type hybridisatie van atomen in verbindingen bepalen? De auteur van de theorie stelde voor om rekening te houden met het mengen van hybride orbitalen.
definitie
Laten we, om te begrijpen hoe we het type hybridisatie in verbindingen kunnen bepalen, onderzoeken wat deze term betekent.
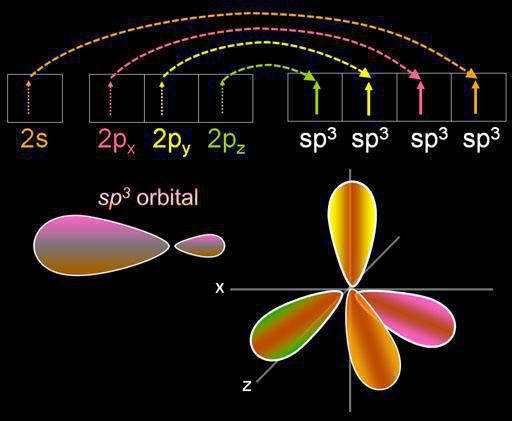
Hybridisatie is een vermengingelektronische orbitalen. Dit proces gaat gepaard met de verdeling van energie in hen, een verandering in hun vorm. Afhankelijk van hoeveel s- en p-orbitalen worden gemengd, kan het type hybridisatie verschillen. In organische verbindingen kan het koolstofatoom bestaan in de toestand sp, sp2, sp3. Er zijn ook complexere vormen waarin, behalve sp, d-orbitalen deelnemen.
Regels voor de detectie van anorganische stoffen in moleculen
Identificeer de hybridisatieoptie voor verbindingenmet een covalente chemische binding, met het type ABn. A is een basisch atoom, B is een ligand en n is een getal van twee of meer. In een dergelijke situatie zullen alleen de valentieorbitalen van het hoofdatoom de hybridisatie vergezellen.
De methoden voor het bepalen
Laten we het wat meer over het bepalen van het type hebbenhybridisatie. In chemische zin impliceert deze term een verandering in de energie en vorm van de orbitalen. Een soortgelijk proces wordt waargenomen in die gevallen waarin elektronen worden gebruikt om de binding te vormen, die tot verschillende typen behoren.

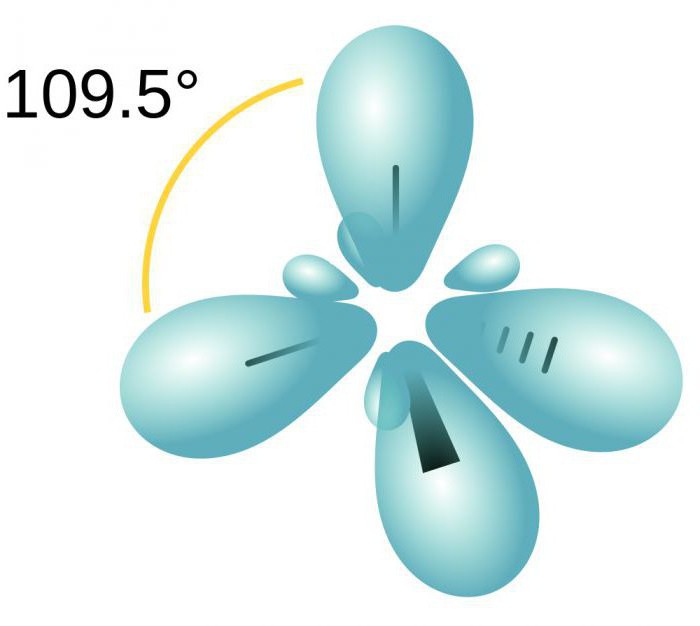
Om te begrijpen hoe het type hybridisatie bepaald moet worden,overweeg het molecuul methaan. Deze stof is de eerste vertegenwoordiger van de homologe reeks verzadigde (beperkende) koolwaterstoffen. In de ruimte is het CH4-molecuul een tetraëder. Het enkele koolstofatoom vormt verbindingen met waterstof, vergelijkbaar in energie en lengte. Om dergelijke hybride wolken te vormen, worden drie p- en één es-elektron gebruikt.
Vier wolken zijn gemengd en er zijn er vieridentieke (hybride) soorten, in de vorm van een onregelmatig cijfer-acht. Dit type hybridisatie wordt sp3 genoemd. Alle koolwaterstoffen, die alleen eenvoudige (enkele) bindingen bevatten, worden gekenmerkt door dit type hybridisatie van een koolstofatoom. De valentijnshoek is 109 graden 28 minuten.
Laten we doorgaan met het gesprek over hoe het type te bepalenhybridisatie. Voorbeelden van onverzadigde koolwaterstoffen uit de ethyleenreeks geven een idee van sp2-hybridisatie. In een ethyleenmolecuul van vier valentie-elektronen bij de vorming van een chemische binding worden bijvoorbeeld slechts drie gebruikt. Het resterende niet-hybride p-elektron gaat naar de vorming van een dubbele binding.
Acetyleen is de eenvoudigste vertegenwoordigerklasse CnH2n-2. Een kenmerk van deze klasse koolwaterstoffen is de aanwezigheid van een drievoudige binding. Van de vier valentie-elektronen van een koolstofatoom veranderen slechts twee hun vorm en energie en worden ze hybride. De twee overblijvende elektronen nemen deel aan de vorming van twee dubbele bindingen, waardoor de onverzadigde aard van deze klasse van organische verbindingen wordt bepaald.
conclusie
Gezien de kwestie van covalentchemische bindingen voor organische en anorganische stoffen, houdt rekening met de hybridisatie van atoomorbitalen. Dit brengt hun energie en vorm op één lijn. Een elektron dat zich nabij de kern van een gebonden atoom bevindt, wordt gekenmerkt door een reeks orbitalen met hetzelfde kwantumnummer. Informatie over het type hybridisatie maakt het mogelijk om de chemische eigenschappen van een stof te evalueren.
</ p>