Het Rutherford-experiment over verstrooiing van alfadeeltjes (kort)
Ernest Rutherford is een van de oprichtersfundamentele theorie van de interne structuur van het atoom. Een wetenschapper werd geboren in Engeland, in een familie van emigranten uit Schotland. Rutherford was het vierde kind in zijn familie, terwijl hij de meest getalenteerde was. Hij leverde een speciale bijdrage aan de theorie van de structuur van het atoom.

Eerste ideeën over de structuur van het atoom
Opgemerkt moet worden dat voor deRutherford's beroemde experiment over de verstrooiing van alfadeeltjes, het toen dominante idee van de structuur van het atoom, was het Thompson-model. Deze wetenschapper wist zeker dat de positieve lading het hele volume van het atoom als geheel uniform vulde. Negatief geladen elektronen, dacht Thompson, waren alsof ze erin geïmpregneerd waren.

Vereisten voor wetenschappelijke revolutie
Na het verlaten van school, Rutherford als het meesteen getalenteerde student ontving een subsidie van 50 pond voor verdere studie. Dankzij dit slaagde hij erin om naar school te gaan in Nieuw-Zeeland. Verder neemt de jonge wetenschapper examens af aan de universiteit van Canterbury en begint hij zich serieus bezig te houden met natuurkunde en scheikunde. In 1891 maakte Rutherford zijn eerste rapport over het thema 'Evolutie van de elementen'. Hierin werd voor het eerst in de geschiedenis het idee uitgedrukt dat atomen complexe structuren zijn.
Vervolgens werden wetenschappelijke kringen gedomineerd door het ideeDalton over het feit dat atomen ondeelbaar zijn. Voor iedereen die Rutherford omsingelde, leek zijn idee perfecte waanzin te zijn. De jonge wetenschapper moest zijn collega's voortdurend excuses aanbieden voor zijn "onzin". Maar 12 jaar later slaagde Rutherford er nog steeds in zijn zaak te bewijzen. Rutherford kreeg de kans om zijn studie voort te zetten aan het Cavendish Laboratory in Engeland, waar hij de ionisatieprocessen van lucht begon te bestuderen. De eerste ontdekking van Rutherford was alfa- en bètastraling.
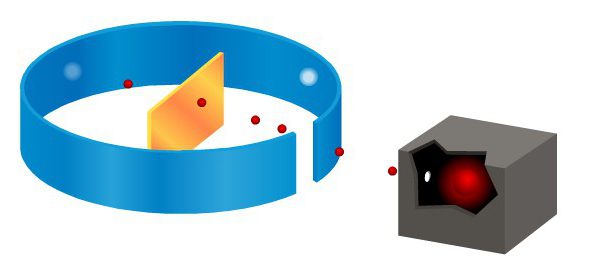
De ervaring van Rutherford
In het kort over de ontdekking kan worden beschreven als volgt: in 1912 voerde Rutherford, samen met zijn assistenten, zijn beroemde experiment uit - de alfadeeltjes werden uitgezonden door een hoofdbron. Alle deeltjes, behalve die deeltjes die geabsorbeerd werden door lood, bewogen langs het gevestigde kanaal. Hun smalle stroom viel op een dunne laag folie. Deze lijn stond loodrecht op het vel. Rutherford's ervaring in het verstrooien van alfadeeltjes bewees dat de deeltjes die door en door het folieblad liepen, zogenaamde scintillaties op het scherm noemden.
Dit scherm was bedekt met een speciale substantie diehet begon te gloeien wanneer alfadeeltjes het raken. De ruimte tussen de goudfolielaag en het scherm was gevuld met vacuüm, zodat de alfadeeltjes niet in de lucht dissiperen. Met een dergelijk apparaat konden de onderzoekers deeltjes observeren die zich onder een hoek van ongeveer 150 ° verspreiden.
Als de folie niet wordt gebruikt als eenobstakels voor een bundel van alfadeeltjes, dan werd een lichte cirkel van scintillaties gevormd op het scherm. Maar zodra ze voor hun straal een barrière van goudfolie hadden, veranderde het beeld enorm. Flitsen verschenen niet alleen buiten deze mok, maar ook aan de andere kant van de folie. Rutherford's ervaring met de verstrooiing van alfadeeltjes heeft aangetoond dat de meeste deeltjes door de folie passeren zonder merkbare veranderingen in de bewegingsbaan.
Tegelijkertijd weken sommige deeltjes afeerder een grote hoek en zelfs teruggegooid. Voor elke 10.000 die vrij door de laag goudfoliedeeltjes passeerde, week slechts één af met een hoek groter dan 10 ° - bij uitzondering werd één van de deeltjes met een dergelijke hoek afgebogen.

De reden voor het afbuigen van alfadeeltjes
Wat de ervaring in detail heeft onderzocht en is bewezenRutherford - de structuur van het atoom. Deze situatie duidde erop dat het atoom geen permanente opleiding vormt. De meeste deeltjes passeren vrij door een folie met een dikte van één atoom. En aangezien de massa van het alfadeeltje bijna 8.000 keer groter is dan de massa van het elektron, kan de laatste het traject van het alfadeeltje niet significant beïnvloeden. Dit kan alleen worden gedaan door een atoomkern - een lichaam van kleine afmetingen, die bijna de gehele massa en de volledige elektrische lading van het atoom bezitten. In die tijd werd het een belangrijke doorbraak van de Engelse fysicus. De ervaring van Rutherford wordt beschouwd als een van de belangrijkste stappen in de ontwikkeling van de wetenschap van de interne structuur van het atoom.
Andere ontdekkingen verkregen tijdens het bestuderen van het atoom
Deze studies werden direct bewijsHet feit dat de positieve lading van een atoom zich binnen de kern bevindt. Dit gebied beslaat een zeer kleine ruimte in vergelijking met de integrale afmetingen. In zo'n klein volume bleek de verstrooiing van alfadeeltjes zeer onwaarschijnlijk. En die deeltjes die langs het gebied van de atoomkern kwamen, hadden scherpe afwijkingen van het traject, omdat de afstotende krachten tussen het alfadeeltje en de kern van het atoom erg krachtig waren. Rutherford's ervaring in het verstrooien van alfadeeltjes heeft de waarschijnlijkheid aangetoond dat een alfadeeltje direct in de kern valt. Inderdaad, de kans was erg klein, maar nog steeds niet gelijk aan nul.
Het was niet het enige feit dat werd bewezende ervaring van Rutherford. De structuur van het atoom werd kort bestudeerd door zijn collega's, die een aantal andere belangrijke ontdekkingen deden. In aanvulling op de leer dat alfadeeltjes snel bewegende heliumkernen zijn.
De wetenschapper was in staat om de structuur van het atoom te beschrijven, waarinde kern neemt een onbelangrijk deel van het hele volume in beslag. Zijn experimenten hebben aangetoond dat praktisch de gehele lading van een atoom geconcentreerd is in zijn kern. In dit geval treden beide gevallen van deflectie van alfadeeltjes op, evenals gevallen van botsing met de kern.

Rutherford's experimenten: het nucleaire model van een atoom
In 1911, Rutherford na tallozeonderzoek suggereerde een model van de structuur van het atoom, dat hij planetair noemde. Volgens dit model is er in het atoom een kern, die praktisch de gehele massa van het deeltje bevat. Elektronen bewegen zich rond de kern, net zoals planeten rond de zon dat doen. Van hun totaliteit wordt een zogenaamde elektronische wolk gevormd. Het atoom heeft een neutrale lading, zoals blijkt uit de ervaring van Rutherford.
De structuur van het atoom in de toekomst geïnteresseerdeen wetenschapper genaamd Niels Bohr. Hij was het die de leer van Rutherford afrondde, want vóór Bohr begon het planetaire model van het atoom moeilijk te verklaren. Omdat het elektron rond de kern beweegt langs een bepaalde baan met versnelling, moet het vroeg of laat op de kern van het atoom vallen. Niels Bohr was echter in staat te bewijzen dat de wetten van de klassieke mechanica niet werken binnen het atoom.
</ p>


